14/10/2010
Prêmio Nobel de Química de 2010
Este ano, três pesquisadores, um americano e dois japoneses, dividem o Prêmio Nobel de Química, concedido anualmente pela Academia Real Sueca de Ciências: Richard F. Heck, professor emérito da Universidade de Delaware, EUA; Ei-ichi Negishi, “Herbert C. Brown Distinguished Professor of Chemistry” da Universidade de Purdue, EUA e Akira Suzuki, professor emérito da Universidade de Hokkaido, Japão. Os três foram agraciados por suas pesquisas envolvendo o uso de reações de acoplamento cruzado catalisadas por paládio em síntese orgânica.
 Cada um deles desenvolveu uma metodologia sintética que leva seus respectivos nomes – acoplamentos de Heck, Negishi e Suzuki - amplamente empregadas em síntese orgânica para a formação de ligações carbono-carbono, um aspecto central na construção de moléculas orgânicas complexas de forma controlada. Esses acoplamentos cruzados têm permitido a síntese de inúmeros compostos orgânicos de enorme utilidade na preparação de fármacos, novos materiais e moléculas biologicamente ativas não só em laboratórios acadêmicos como também pela indústria em geral, onde essas metodologias tem se mostrado extremamente versáteis e econômicas. Cada um deles desenvolveu uma metodologia sintética que leva seus respectivos nomes – acoplamentos de Heck, Negishi e Suzuki - amplamente empregadas em síntese orgânica para a formação de ligações carbono-carbono, um aspecto central na construção de moléculas orgânicas complexas de forma controlada. Esses acoplamentos cruzados têm permitido a síntese de inúmeros compostos orgânicos de enorme utilidade na preparação de fármacos, novos materiais e moléculas biologicamente ativas não só em laboratórios acadêmicos como também pela indústria em geral, onde essas metodologias tem se mostrado extremamente versáteis e econômicas.
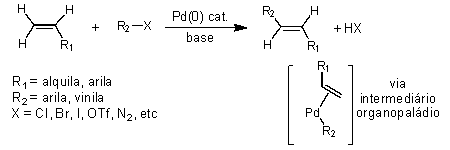
A reação de Heck foi a primeira a surgir em 1968, quando Richard Heck, então pesquisador na empresa Hercules Inc., EUA, relatou a reação entre uma olefina e compostos organomercuriais catalisada por paládio em quantidades estequiométricas, uma reação que chamou muito pouco a atenção da comunidade química naquela época em razão do uso de compostos pouco acessíveis e tóxicos, os organomercuriais, e o emprego de grandes quantidades de paládio, um metal de transição relativamente caro. Em 1971, T. Mizoroki no Japão, atento ao potencial desse processo de síntese, relatou o primeiro exemplo dessa reação empregando quantidades catalíticas de paládio, substituindo os compostos arilmercuriais por iodetos de arila na presença de uma base, o acetato de potássio. Logo a seguir (1972), Heck também propôs uma versão catalítica para o processo desenvolvido por ele anteriormente, substituindo os arilmercuriais por haletos de arila, em condições mais brandas do que aquelas descritas por Mizoroki. Nascia assim a reação de Heck-Mizoroki (Esquema 1). Mizoroki foi pouco ativo no desenvolvimento posterior da reação, vindo a falecer, ainda jovem, oito anos depois. Heck, além de descobridor da reação, propôs também um mecanismo coerente para o processo catalítico, válido até hoje em suas linhas gerais.
Esquema 1
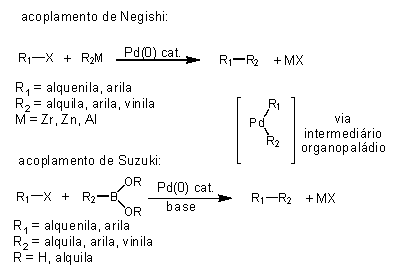
Os acoplamentos cruzados desenvolvidos por Negishi e Suzuki estão relacionados a reações promovidas por paládio catalítico de um composto organometálico (organozircônio, organoaluminio ou organozinco no caso de Negishi) ou compostos organoboro (boranas, ácidos borônicos ou boronatos, no caso de Suzuki) com um haleto de arila ou alquenila (Esquema 2).
Esquema 2
Os acoplamentos cruzados surgiram em 1972, na Universidade de Kioto, Japão, com os profs. M. Kumada e K. Tamao, seguindo os passos de outro pesquisador japonês, o prof. A. Yamamoto que investigava a decomposição (eliminação redutiva) do composto organometálico dietilníquel. O grupo de Kioto foi pioneiro na realização de acoplamentos entre composto organomagnésio (reagentes de Grignard) e haletos de arila ou alquenila promovidos por níquel. Quase simultaneamente e de forma independente, o mesmo tipo de acoplamento cruzado foi relatado por Robert Corriu, da Universidade de Montpellier, França. O emprego de paládio como catalisador nessas reações foi introduzido posteriormente por Shun-ichi Murahashi em 1975.
O acoplamento de Negishi surgiu em 1976 e deu grande impulso a esses processos em razão do uso de compostos organometálicos menos reativos e mais tolerantes a funções orgânicas que os organolitio e organomagnésio, estendendo consideravelmente o potencial sintético das reações de acoplamento. Negishi também está dentre os primeiros a utilizar Pd nas reações de acoplamento em substituição ao Ni.
O acoplamento de Suzuki-Miyaura por sua vez surgiu somente em 1979 fazendo uso de ácidos borônicos para as reações com brometos de arila e alquenila catalisadas por Pd. Curiosamente este tipo de acoplamento havia sido testado anteriormente por Negishi sem sucesso. O aspecto novo idealizado pelos pesquisadores da Universidade de Hokkaido foi a realização dos acoplamentos em meio aquoso básico, permitindo assim a ativação dos compostos organoboro nos acoplamentos cruzados.
Uma das razões para o destaque alcançado por essas reações ao longo das últimas décadas é a enorme capacidade de aplicação das três “name reactions” em processos industriais, com destaque aqui para a indústria farmacêutica, que emprega essas reações de acoplamento na escala de centenas de quilos para produzir diversos fármacos de forma econômica e ambientalmente segura, com baixo volume de resíduos. Além de fármacos esses processos têm sido aplicados em grande escala na produção de compostos importantes para a indústria eletro-eletrônica.
No “front” acadêmico, a atual visibilidade das reações de acoplamento vem demonstrar a vitalidade da Química Orgânica, em particular dos compostos organometálicos, em gerar metodologias de síntese que possibilitem a construção eficaz de moléculas orgânicas complexas de formas régio e estéreo-controladas.
Fonte: Carlos Roque Duarte Correia (UNICAMP)
Nota do Editor: O Prêmio Nobel de Química foi concedido pela primeira vez em 1901 a Jacobus H. van 't Hoff. No total, o Nobel de Química foi concedido 102 vezes para 160 Laureados, entre os anos de 1901 e 2010. Frederick Sanger é o único Laureado duas vezes com o Prêmio Nobel de Química, em 1958 e 1980. Portanto, foram 159 laureados com o Prêmio Nobel de Química.
|